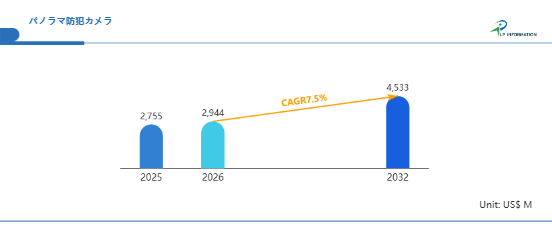
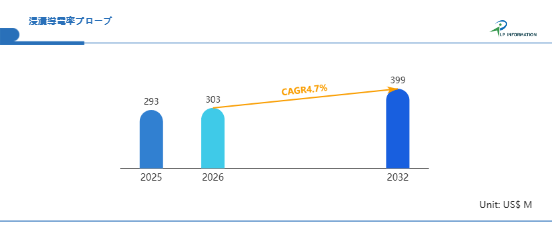
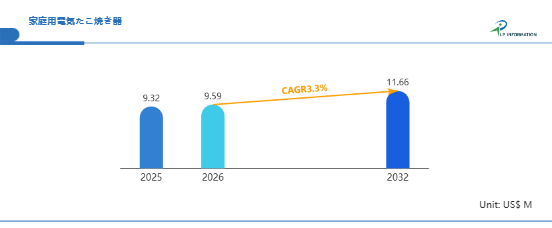
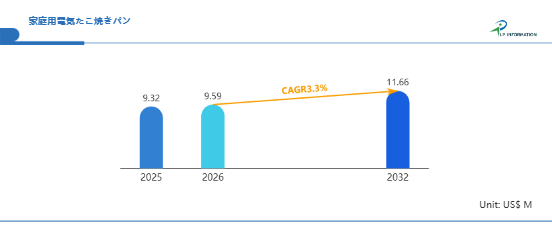
エマーゴ薬事規制セミナー 新欧州医療機器規制(MDR)解説セミナー
~2020年MDR完全施行までのレギュラトリーロードマップ~
イベント
2017年7月25日 10:30エマーゴ・ジャパン・コンサルティング株式会社(所在地:東京都新宿区、事業部長兼事業開発部長:宮原 通晴)は、2017年5月に欧州で発効された、医療機器を規制する新しい法枠組みとして医療機器規制(Medical Device Regulation(MDR))および体外診断用医療機器規制(IVDR)についてのセミナーを2017年9月5日(火)に東京、6日(水)には大阪で開催いたします。
欧州では従来、医療機器指令(MDD)、埋め込み式医療機器指令(AIMDD)そして体外診断用医療機器指令(IVDD)に基づくCEマーキング制度によりこれらの製品の品質が規制されてきましたが、今次法改正により、これらの指令がMDR、IVDRに置き換わり、引き続きCEマーキング制度の下で規制されることになります。CEマーキングを実行されている、あるいはこれから取り組まれる医療機器関連事業者は、この新しい法枠組みと要求事項を十分に理解し定められた期間内にコンプライアンスを確実にすることが求められています。
本セミナーでは、現在MDRのギャップ分析支援を手がけるEmergo Groupのコンサルタントを招き、MDR適合へのロードマップについて共有したいと思います
URL: http://www.emergojapan.co.jp/seminar2017
■セミナー概要
本セミナーPart1では、MDR/IVDRの概要から新しい要求事項の説明、また、対象事業者がこれから取り組むべき主な課題と想定される対応スケジュールについてアドバイスいたします。またMDRに関しては、今後さらに理解を深めるためのガイダンスや関連文書の発行が予想されています。最新情報についても併せて報告予定です。
MDRは、CEマーキング制度の継続など、従来の指令と比べて類似点は多いものの、今回の法改正で欧州の医療機器規制体制はいくつかの点で厳格化されています。そのうちの一つが臨床データに関する要求です。CEマーキングの要求事項の一つである臨床評価報告書については、昨年関連するガイダンス文書(MEDDEV 2.7/1 rev 4)が更新され、この内容はMDRにおける臨床データ要求の考え方を理解する上で重要なガイダンスとなっています。Par 2では、欧州における臨床データおける要求事項を取り上げ、MEDDEV 2.7/1 rev 4の解説を中心に、MDRにおける臨床データ要求における考え方についてアドバイスいたします。
■日時・受講料
東京会場
日時 :2017年9月5日(火)13:00-16:00
会場 :アルカディア市ヶ谷(定員90名)
最寄り駅:JR総武線及び東京メトロ「市ヶ谷」駅
*受付開始は12時30分からとなります。
大阪会場
日時 :2017年9月6日(水)13:00-16:00
会場 :グランキューブ大阪(定員40名)
最寄り駅:京阪電車中之島線「中之島(大阪国際会議場)駅」(2番出口)すぐ
*受付開始は12時30分からとなります。
受講料:15,000円(消費税、テキスト代を含みます)
■セミナープログラム
【開会のご挨拶】(13:00-13:05)
エマーゴ・ジャパン・コンサルティング 事業部長兼事業開発部長 宮原 通晴
【Part1:欧州医療機器規制(MDR)の概要と対応スケジュール】(13:05-14:00)
講師:Jane Arnold-Round
Senior Regulatory Consultant
Emergo Group
- 欧州医療機器規制について
- MDR/IVDR概要と移行スケジュール
- MDR/IVDRにおけるキープレイヤー(経済事業者)とその責任、役割
- 認証機関の認定
- 基本安全性能要件(MDR General Safety and Performance Requirement)
- テクニカルファイル、クラス分類、適合性評価、臨床評価報告書
【Q&A】(14:00-14:15)
【休憩】(14:15-14:25)
【Part2:欧州における医療機器のための臨床データ要件(MEDDEV 2.7/1 rev 4)】(14:25-15:45)
講師:Jane Arnold-Round
Senior Regulatory Consultant
Emergo Group
- MDD/AIMDDにおける臨床データ
- MEDDEV 2.7/1 rev 4の概要
- 一般原則と評価プロセス
- ステージ0:スコープ、同等性
- ステージ1:関連するデータの特定
- ステージ2:関連するデータの評価
- ステージ3:データ分析
- ステージ4:臨床評価報告書
- MDRにおける臨床データ
【全体の質疑応答】(15:45-16:00)
プログラムは若干の変更がある場合がございます。
■お申し込み方法
お申し込みは下記よりお願いいたします。
*お申し込みが定員に達し次第、締め切らせていただきます。
(コンサルタントの方のご参加はご遠慮願います。)
*キャンセルの取り扱いについて
キャンセルについては、セミナー10日前から50%、前日からは100%のキャンセル料をご請求させていただきます。
欧州では従来、医療機器指令(MDD)、埋め込み式医療機器指令(AIMDD)そして体外診断用医療機器指令(IVDD)に基づくCEマーキング制度によりこれらの製品の品質が規制されてきましたが、今次法改正により、これらの指令がMDR、IVDRに置き換わり、引き続きCEマーキング制度の下で規制されることになります。CEマーキングを実行されている、あるいはこれから取り組まれる医療機器関連事業者は、この新しい法枠組みと要求事項を十分に理解し定められた期間内にコンプライアンスを確実にすることが求められています。
本セミナーでは、現在MDRのギャップ分析支援を手がけるEmergo Groupのコンサルタントを招き、MDR適合へのロードマップについて共有したいと思います
URL: http://www.emergojapan.co.jp/seminar2017
■セミナー概要
本セミナーPart1では、MDR/IVDRの概要から新しい要求事項の説明、また、対象事業者がこれから取り組むべき主な課題と想定される対応スケジュールについてアドバイスいたします。またMDRに関しては、今後さらに理解を深めるためのガイダンスや関連文書の発行が予想されています。最新情報についても併せて報告予定です。
MDRは、CEマーキング制度の継続など、従来の指令と比べて類似点は多いものの、今回の法改正で欧州の医療機器規制体制はいくつかの点で厳格化されています。そのうちの一つが臨床データに関する要求です。CEマーキングの要求事項の一つである臨床評価報告書については、昨年関連するガイダンス文書(MEDDEV 2.7/1 rev 4)が更新され、この内容はMDRにおける臨床データ要求の考え方を理解する上で重要なガイダンスとなっています。Par 2では、欧州における臨床データおける要求事項を取り上げ、MEDDEV 2.7/1 rev 4の解説を中心に、MDRにおける臨床データ要求における考え方についてアドバイスいたします。
■日時・受講料
東京会場
日時 :2017年9月5日(火)13:00-16:00
会場 :アルカディア市ヶ谷(定員90名)
最寄り駅:JR総武線及び東京メトロ「市ヶ谷」駅
*受付開始は12時30分からとなります。
大阪会場
日時 :2017年9月6日(水)13:00-16:00
会場 :グランキューブ大阪(定員40名)
最寄り駅:京阪電車中之島線「中之島(大阪国際会議場)駅」(2番出口)すぐ
*受付開始は12時30分からとなります。
受講料:15,000円(消費税、テキスト代を含みます)
■セミナープログラム
【開会のご挨拶】(13:00-13:05)
エマーゴ・ジャパン・コンサルティング 事業部長兼事業開発部長 宮原 通晴
【Part1:欧州医療機器規制(MDR)の概要と対応スケジュール】(13:05-14:00)
講師:Jane Arnold-Round
Senior Regulatory Consultant
Emergo Group
- 欧州医療機器規制について
- MDR/IVDR概要と移行スケジュール
- MDR/IVDRにおけるキープレイヤー(経済事業者)とその責任、役割
- 認証機関の認定
- 基本安全性能要件(MDR General Safety and Performance Requirement)
- テクニカルファイル、クラス分類、適合性評価、臨床評価報告書
【Q&A】(14:00-14:15)
【休憩】(14:15-14:25)
【Part2:欧州における医療機器のための臨床データ要件(MEDDEV 2.7/1 rev 4)】(14:25-15:45)
講師:Jane Arnold-Round
Senior Regulatory Consultant
Emergo Group
- MDD/AIMDDにおける臨床データ
- MEDDEV 2.7/1 rev 4の概要
- 一般原則と評価プロセス
- ステージ0:スコープ、同等性
- ステージ1:関連するデータの特定
- ステージ2:関連するデータの評価
- ステージ3:データ分析
- ステージ4:臨床評価報告書
- MDRにおける臨床データ
【全体の質疑応答】(15:45-16:00)
プログラムは若干の変更がある場合がございます。
■お申し込み方法
お申し込みは下記よりお願いいたします。
*お申し込みが定員に達し次第、締め切らせていただきます。
(コンサルタントの方のご参加はご遠慮願います。)
*キャンセルの取り扱いについて
キャンセルについては、セミナー10日前から50%、前日からは100%のキャンセル料をご請求させていただきます。