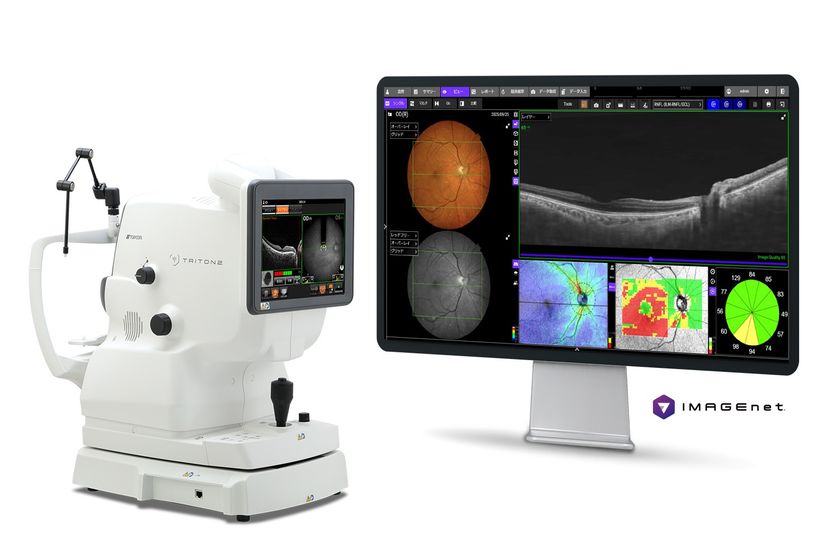
アレクシオン、難治性全身型重症筋無力症(gMG)の治療薬として ソリリス(R)(エクリズマブ)を米国およびEUで承認申請
調査・報告
2017年1月18日 15:00この資料は、アレクシオン・ファーマシューティカルズ(米国コネチカット州ニューヘイブン)が2017年1月9日(現地時間)に発表したプレスリリースの日本語抄訳で、参考資料として提供するものです。その内容および解釈については英文プレスリリースが優先されます。英文プレスリリースは http://www.alexion.com をご参照ください。
2017年1月9日、米国コネチカット州ニューヘイブン--アレクシオン・ファーマシューティカルズは本日、抗アセチルコリン受容体(AChR)抗体陽性の難治性全身型重症筋無力症(gMG)患者さんの治療薬としてソリリス(R)(エクリズマブ)の適応を拡大するため、米国食品医薬品局(FDA)および欧州医薬品庁(EMA)に承認申請したことを発表しました。欧州連合(EU)での申請は欧州医薬品庁(EMA)により受理され、ソリリスの新たな適応について欧州での審査が開始されました。米国およびEUでの承認申請は、第III相REGAIN試験の総合的なデータに基づき行われました。
ソリリスのこの新たな適応が承認されれば、従来の治療法を尽くしても症状が持続する難治性gMG患者さんの重大なアンメットニーズを満たすことができます。抗AChR抗体陽性の難治性gMGは、補体介在性の消耗性神経筋疾患であるMGの中で極めて稀ではありますが、患者さんは、全身の筋力が著しく低下し、その結果として不明瞭な会話、嚥下障害、むせ、複視、日常生活に支障を来すほどの疲労感、呼吸筋の筋力低下による息切れ、長期入院を伴う頻繁な来院やICUへの入室、および呼吸不全に至ります(参考文献1-6)。
「難治性gMGの患者さんは効果的な治療法を緊急に必要としています。この深刻な超希少疾患の患者さんにとって有効な治療法がないため、歩行、会話、嚥下、そして正常に呼吸するといった日常生活にも支障をきたします」と、アレクシオンのエグゼクティブ・バイスプレジデントでR&Dグローバルヘッドのマーティン・マッケイは述べています。「米国と欧州の規制当局へ承認申請したことで、抗AChR抗体陽性の難治性gMGに苦しむ患者さんの生活を一変させるという私たちの目標へさらに一歩近づきました。今後は、規制当局の審査に協力して参ります」
ソリリスはMG患者さんの治療薬として、米国およびEUにおいて希少疾病用医薬品指定(ODD)を取得しています。ソリリスが難治性gMG患者さんの治療薬として承認されている国はありません。
■難治性全身型重症筋無力症について
補体介在性の消耗性神経筋疾患であるMGの中で、抗AChR抗体陽性の難治性全身型重症筋無力症(gMG)は極めて稀です。難治性gMG患者さんは、MGに対して現在利用可能な治療があるにもかかわらず重症化します(参考文献1、2、3)。
MGは一般的に、眼筋の筋力低下から始まり、しばしばさらに重症化して、頭部、頸部、体幹、四肢および呼吸筋の筋力低下など、gMGとして知られる全身型へと進行します(参考文献7)。gMG患者さんの大半の症状は従来の治療法でコントロールされていますが、10~15%の患者さんは難治性と判断されています。難治性の患者さんは従来の治療法を尽くしても、全身の著しい筋力低下が継続し、その結果として不明瞭な会話、嚥下障害、むせ、複視、日常生活に支障を来すほどの疲労感、呼吸筋の筋力低下による息切れ、長期入院を伴う頻繁な来院やICUへの入室、および呼吸不全に至ります(参考文献4、5、6、8)。
現在、難治性gMGという超希少疾患に苦しむ患者さんに有効な治療法はありません。
■ソリリス(R)(エクリズマブ)について
ソリリスは、アレクシオンが研究開発から当局の承認、上市までを行ったファースト・イン・クラスの終末補体阻害剤です。ソリリスは、米国(2007)、欧州連合(2007)、日本(2010)およびその他の国々の規制当局から、発作性夜間ヘモグロビン尿症(PNH)の患者さんに対する溶血を抑制する最初で唯一の治療薬としての承認を受けています。PNHは、補体介在性溶血(赤血球細胞の破壊)を特徴とする、生命を脅かす超希少かつ消耗性の血液疾患です。ソリリスはまた、米国(2011)、欧州連合(2011)、日本(2013)およびその他の国々において、非典型溶血性尿毒症症候群(aHUS)の患者さんに対する補体介在性血栓性微小血管症、つまりTMA(微小血管の血栓)を抑制する最初で唯一の治療薬としても承認を受けています。このaHUSは補体介在性TMAを特徴とする、超希少かつ致命的な消耗性の遺伝性疾患です。ソリリスは、志賀毒素産生大腸菌由来溶血性尿毒症症候群(STEC-HUS)の患者さんの治療は適応としていません。
補体阻害における画期的な医療革新に対し、アレクシオンとソリリスは2008年度ベストバイオテクノロジー医薬品として米ガリアン賞を受賞したほか、2009年度仏ガリアン賞の希少疾患用医薬品部門を受賞するなど、製薬業界最高の栄誉を受けました。
■アレクシオンについて
アレクシオンは、重篤な希少疾患を抱える患者さんの生活を一変させる治療薬の開発と提供に注力するグローバルなバイオ製薬企業です。アレクシオンは補体阻害におけるグローバルリーダーであり、生命を脅かす2つの超希少疾患である発作性夜間ヘモグロビン尿症(PNH)および非典型溶血性尿毒症症候群(aHUS)の治療薬として初めてかつ唯一承認されている補体阻害薬を開発し、製造販売しています。また、アレクシオンの代謝性フランチャイズは、低ホスファターゼ症(HPP)とライソゾーム酸性リパーゼ欠損症(LAL-D)といった生命を脅かす超希少疾患の患者さんに対する2つの非常に革新的な酵素補充療法を有しています。さらに、アレクシオンは、複数の治療領域にわたる極めて革新的な製品候補を擁し、バイオテクノロジー業界において最も強固な希少疾患パイプラインを進展させています。本プレスリリースとアレクシオンに関する詳細については http://www.alexion.com/ をご覧ください。
■参考文献
1. Suh J, Goldstein JM, Nowak RJ. Clinical characteristics of refractory myasthenia gravis patients. Yale J Biol Med. 2013; 86:255-60.
2. Gilhus NE, Verschuuren JJ. Myasthenia gravis: subgroup classification and therapeutic strategies. Lancet Neurol. 2015; 14:1023-36.
3. Drachman D, Adams R, Hu R, Jones R, Brodsky R. Rebooting the immune system with high-dose cyclophosphamide for treatment of refractory myasthenia gravis. Ann NY Acad Sci. 2008; 1132:305-314.
4. Sathasivam S. Diagnosis and management of myasthenia gravis. Prog Neurol Psychiatry. 2014; 18(1):6-14.
5. Howard JF, ed. Myasthenia Gravis: A Manual for the Health Care Provider. St. Paul, MN: Myasthenia Gravis Foundation of America, Inc.; 2008.
6. Safety and efficacy of eculizumab in refractory generalized myasthenia gravis (REGAIN study). Clinicaltrials.gov identifier NCT01997229.
7. Melzer N, Ruck T, Fuhr P, et al. Clinical features, pathogenesis, and treatment of myasthenia gravis: a supplement to the Guidelines of the German Neurological Society. J Neurol. 2016 Feb 17. [Epub ahead of print]
8. Targeting the Complement System in Refractory Myasthenia Gravis. Supplement to Neurology Reviews. February 2016.










![シール活動が楽しくなるサンリオのキュートなシール新作一覧に![予約受付開始]](https://newscast.jp/attachments/bddpkvVIjQuRtE8S6r6K.jpg)