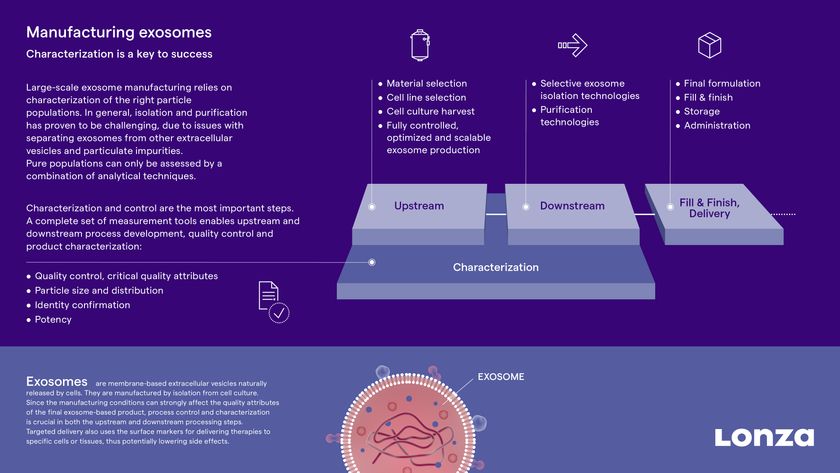
米Moderna社とLonzaは、新型コロナウイルスワクチン 「mRNA-1273」を製造するための世界的な戦略的提携を発表
2020年5月1日、ケンブリッジ(米国マサチューセッツ州)、バーゼル(スイス) - メッセンジャーRNA(mRNA)治療薬およびワクチンのパイオニアで、新世代の革新的な医薬品を創造するための治験段階のバイオテクノロジー企業、Moderna, Inc., (Nasdaq:MRNA)と、Lonza Ltd.(SIX:LONN)は、本日、新型コロナウイルス(SARS-CoV-2)に対するModerna社のmRNAワクチン(mRNA-1273)および将来その他のModerna社製品の大規模製造を可能にするための10年間の戦略的業務提携契約を発表しました。
合意条件に基づき、両社はmRNA-1273を製造するために、米国およびスイスのLonzaの施設に製造設備を開設する予定です。技術移転は2020年6月に開始する見込みであり、2020年7月にはLonza U.SでmRNA-1273の最初のバッチを製造する予定です。長期的には、両社は、Lonzaの世界中の製造拠点にわたって追加の製造設備を確立することを計画し、最終的には、現在予想される投与量を50μgと仮定して、世界中で年間最大10億回投与分に相当するmRNA-1273の製造を可能にします。Lonzaの製造設備は、Moderna社が現在進めている米国での製造設備を補完するものであり、mRNA-1273のさらなる臨床開発と商業化に向けて準備を進めています。
2020年4月16日に発表されたアメリカ合衆国保健福祉省の準備・対応事務局の一部であるBiomedical Advanced Research and Development Authority(BARDA)とModerna社の契約により、Lonza U.Sにおける製造業務の設立に対する資金の一部がカバーされています。BARDAはmRNA-1273の後期臨床開発プログラムを支援します。複数の薬事規制当局への50以上の商業的承認申請を支援してきた等、革新的な医薬品の製造規模拡大に貢献してきたLonzaの実績は、Moderna社の世界的供給をサポートすることになります。
Moderna社は2020年4月27日、第1相臨床試験の安全性データにより裏付けられるという条件付きで、米国食品医薬品局(FDA)に、mRNA-1273の第2相試験および後期試験についてIND(Investigational New Drug)申請を提出したと発表しました。( https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-ind-submitted-us-fda-phase-2-study-mrna ) Moderna社は、計画中の第2相試験のデザインについて、FDAから最初のフィードバックを受けており、試験は2020年の第2四半期に開始される見込みです。この第2相試験では、mRNA-1273を28日間隔で2回接種した場合の安全性、反応源性および免疫原性を評価します。各被験者は、両方のワクチン接種でプラセボ、50μg又は250μgの用量を受けるように割り当てられます。同社は、18~55歳の成人(n=300)と55歳以上の高齢者(n=300)の2つの群にわたって、計600人の健常者を参加登録する計画です。参加者は、2回目のワクチン接種から12カ月間追跡調査されます。
■mRNA-1273について
mRNA-1273はSpike(S)蛋白質の前融合安定化型をコードするSARS-CoV-2に対するmRNAワクチンであり、NIHの一部であるアメリカ国立アレルギー・感染症研究所(NIAID)のワクチン研究センター(VRC)の研究者らと共同でModerna社が選択しました。Coalition for Epidemic Preparedness Innovationsの資金提供を受けた最初の臨床バッチは2020年2月7日に完了し、分析検査を受けました。遺伝子配列選択から42日後の2月24日にNIHに発送されました。mRNA-1273のNIAID主導の第1相試験の最初の治験参加者は、第1相試験の遺伝子配列選択から63日後である、3月16日に投与されました。SARS-CoV-2に関する現在までの同社の研究の要約は、こちらに掲載されています。( https://www.modernatx.com/modernas-work-potential-vaccine-against-covid-19 )
■NIAID主導の第1相試験について
mRNA-1273のオープンラベル第1相試験は、アメリカ国立アレルギー・感染症研究所が独自の治験薬(IND)申請のもとで米国で実施中です。2020年3月16日に開始された第1相試験では、当初の3用量群(25μg、100μg及び250μg)に18~55歳の健康成人ボランティア45人の登録が完了しました。この研究では、さらに6つの群が登録されています:高齢者(56~70歳)の3つの群と年配者(71歳以上)の3つの群。18~55歳の健常成人ボランティアの元の群からのデータは、入手可能になり次第報告いたします。
■追加情報および免責条項
Lonzaグループは、スイスのバーゼルに本社を置き、スイス証券取引所に上場しています。また、シンガポール証券取引所(「SGX-ST」)に二部上場しています。LonzaグループはSGXSTの継続上場条件の対象ではありませんが、引き続きSGXST上場マニュアルの規則217および751の対象となります。
本ニュース・リリースの記載事項は、将来の予測に関する記述を含む場合があります。これらの記述は、Lonzaグループの現在の予測と推定に基づいており、これらの予測と推定の達成をLonzaグループが保証するものではありません。投資家の皆さまは、すべての将来の予測に関する記述がリスクと不確かさを含んでおり、全体として制限されていることにご注意ください。本ニュース・リリースに含まれる将来の予測に関する記述は、さまざまな要因により、実際の結果と大きく異なる場合があります。また、Lonzaグループは、法律により要求される場合を除き、本ニュース・リリースに含まれる記述を更新する意図を有するものではなく、また、義務を負うものではありません。
本ニュース・リリースは、Lonza Group Ltd が、2020 年5月1 日(スイス現地時間)に発表したニュース・リリースを日本語に翻訳再編集したものです。本資料の正式言語は英語であり、その内容・解釈については英語が優先します。
英文ニュース・リリースについては、こちらをご覧ください。
https://lonza.com/news/2020-05-01-04-50
タイトル:Moderna and Lonza Announce Worldwide Strategic Collaboration to Manufacture Moderna’s Vaccine (mRNA-1273) Against Novel Coronavirus